Theo FDA (Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ) thuốc dạ dày Zantac của tập đoàn dược phẩm GSK có chứa một loại tạp chất làm tăng nguy cơ bị ung thư cho người sử dụng. Do đó loại thuốc này đã được thu hồi trên toàn thế giới.
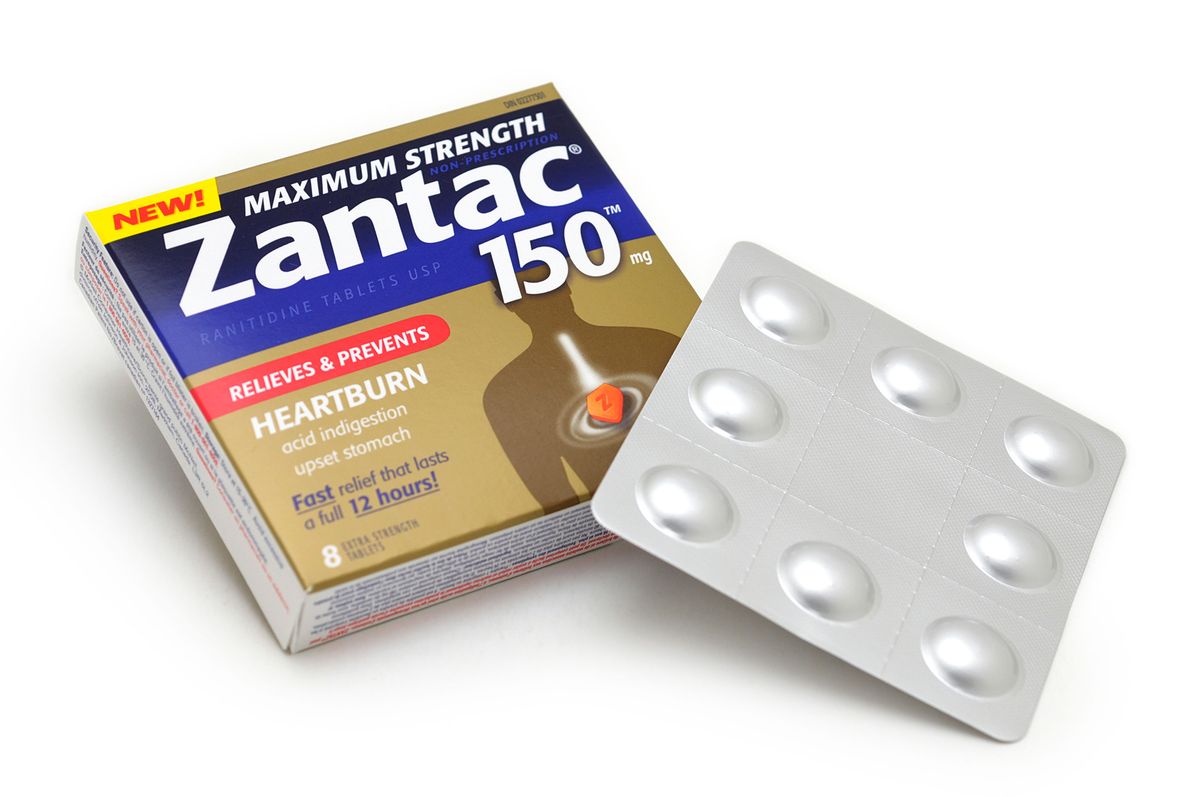
Thu hồi thuốc dạ dày gây ung thư
Thuốc Zantac được sản xuất bởi tập đoàn dược phẩm GSK bao gồm 4 dạng bào chế chính là siro, tiêm, viên 150 mg và 300 mg. Hiện nay cả 4 loại thuốc này đều được thu hồi lại trên toàn cầu.
Nguyên nhân là do Cục Quản lý Thực phẩm và Dược phẩm Mỹ (FDA) phát hiện khối lượng NDMA, tạp chất có khả năng gây ung thư, vượt quá ngưỡng cho phép trong các thuốc Zantac và generic chứa dược chất Ranitidine.
Cơ quan quản lý Mỹ yêu cầu các nhà sản xuất thuốc chứa dược chất Ranitidine tự kiểm nghiệm tạp chất và gửi mẫu sản phẩm để cơ quan này kiểm tra.
NDMA (nitrosodimethylamine) là một phụ phẩm công nghiệp, dùng trong nhiều ngành sản xuất, kể cả làm nhiên liệu tên lửa. Chất này hiện diện với hàm lượng nhỏ trong thực phẩm, đặc biệt là các loại thực phẩm chế biến sẵn, hong khói hoặc ướp muối. NDMA gây độc cho gan và một số cơ quan nội tạng, nó cũng có thể gây ung bướu ở người.
Các nhà quản lý y tế Mỹ và châu Âu cho biết đã tiến hành kiểm tra độ an toàn của dược chất Ranitidine sau khi hãng dược phẩm Valisure phát hiện tạp chất NDMA trong thuốc Zantac. FDA cho biết phương pháp thử nghiệm nhiệt độ cao của Valisure đã tạo ra nồng độ NDMA rất cao từ Ranitidine.
Trong tháng 9, cơ quan Khoa học y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) lần lượt thu hồi 11 loại Zantac và thuốc generic có thành phần Ranitidine trên thị trường. Hong Kong và Ireland đã thu hồi lần lượt bốn và 13 sản phẩm.
Phát ngôn viên của hãng dược phẩm GSK cho biết :"GSK đã thông báo với Cơ quan Quản lý Y Dược Anh (MHRA) về quyết định đình chỉ phát hành, phân phối và cung cấp tất cả các dạng sản phẩm Zantac"
Bên cạnh đó các chuyên gia sức khỏe đã được thông báo dừng cung cấp những thuốc này ngay lập tức, niêm phong tất cả số thuốc còn lại, trả lại cho nhà cung cấp. Tuy nhiên với bệnh nhân thì không cần ngừng thuốc, đi khám theo lịch hẹn thông thường và chỉ cần gặp ngay bác sĩ nếu có thắc mắc cần giải đáp.
Tại Việt Nam, ngày 3/10, Cục Quản lý Dược, Bộ Y tế, thu hồi 11 loại thuốc có thành phần Ranitidine chứa tạp chất NDMA, yêu cầu các cơ sở sản xuất thuốc chứa dược chất Ranitidine chỉ được dùng những lô nguyên liệu không có tạp chất NDMA hoặc NDMA không quá 0.32 ppm.
Năm 2018, cùng với nhiều nước khác, Việt Nam đã thu hồi 57 loại thuốc tim mạch chứa hoạt chất Vasartan vì có NDMA.
>>> Xem thêm:







.jpg)


























.jpg)



.png)
.png)